Tugas Portofolio :
Rancanglah suatu
ikatan karbon-karbon dimana reaksi nucleophilles, reagen tersier dan electrophilep tersier, kondisi dan
namanya?
Senyawa
Organologam dan Reaksinya
Cabang ilmu kimia yang mempelajari tentang ikatan
antara senyawa organic (mengandung atom Carbon) dan anorganik (logam) yaitu
organologam. Organologam sangat erat kaitannya dengan logam-logam yang terikat
dengan Carbon. Tetapi perlu diketahui bahwa senyawa organologam sangat kompleks
susunannya.
Reaksi yang terjadi pada senyawa organologam bisa
dibilang sangat kompleks Karena melibatkan reaksi-reaksi ligan organik dan
bagaimana ligan tersebut berikatan dengan atom logam. Aplikasi senyawa
organologam yang mungkin paling menonjol adalah sebagai katalis. Sebagai contoh
apabila kita memiliki senyawa organik A dan B, dimana kita berkeinginan untuk
menggabungkan rantai karbon milik A dan B. Agar kedua senyawa tersebut dapat
bergabung maka dibutuhkanlah suatu katalis organologam
dimana dia akan melakukan berbagai macam reaksi sampai senyawa A dan B bisa
bergabung dan katalis itu sendiri akan melepaskan diri.
Senyawa organologam adalah senyawa di mana atom-atom
karbon dari gugus organik terikat kepada atom logam. Contoh, suatu aloksida
seperti (C3H7O)4Ti tidaklah dianggap sebagai
suatu senyawa organologam karena gugus organiknya terikat pada Ti melalui
oksigen, sedangkan C6H5Ti(OC3H7)3 karena
terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam
Ti.HH Istilah organologam biasanya didefenisikan agak longgar, dan senyawaan
dari unsur-unsur seperti Boron, fosfor, dan silikon semuanya mirip logam. Tetapi
untuk senyawa yang mengandung ikatan antara atom logam dengan oksigen,
belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk sebagai senyawa
organologam. Dari bentuk ikatan pada senyawa organologam, senyawa ini dapat
dikatakan sebagai jembatan antara kimia organik dan anorganik.
Sifat senyawa organologam yang umum ialah atom karbon
yang lebih elektronegatif daripada kebanyakan logamnya. Senyawa komplek logam
(biasanya logam-logam transisi) merupakan senyawa yang memiliki satu atau lebih
ikatan logam-karbon. Senyawa organologam terdiri dari atom pusat dan ligan.
Terdapat
beberapa kecenderungan jenis-jenis ikatan yang terbentuk pada senyawaan
organologam:
a.
Senyawaan
ionik dari logam elektropositif
Garam logam
ion-ion karbon yang kestabilannya diperkuat oleh delokalisasi elektron lebih
stabil walaupun masih relatif reaktif. Adapun contoh gugus organik dalam
garam-garaman tersebut seperti (C6H5)3C-Na+ dan
(C5H5)2Ca2+.
b.
Senyawaan yang
memiliki ikatan -σ (sigma)
Senyawaan
organologam dimana
sisa organiknya terikat pada suatu atom logam dengan suatu ikatan yang
digolongkan sebagai ikatan kovalen (walaupun masih ada karakter-karakter ionik
dari senyawaan ini) yang dibentuk oleh kebanyakan logam dengan
keelektropositifan yang relatif lebih rendah dari golongan pertama di atas,
Pada
dasarnya Organologam prinsipnya yaitu atom-atom Karbon dari gugus organik
terikat kepada atom logam. Konsep ini yang mendasari Organologam, sehingga
banyak cara untuk menghasilkan ikatan-ikatan logam pada Carbon yang berguna
bagi kedua logam transisi dan non-transisi. Beberapa yang lebih penting adalah
sebagai berikut:
1. Reaksi Logam
langsung ; sintesis yang paling awal oleh ahli kimia Inggris,
Frankland dalam tahun 1845 adalah interaksi antara Zn dan suatu alkil
Halida. Adapun yang lebih berguna adalah penemuan ahli kimia Perancis, Grignard
yang dikenal sebagai pereaksi Grignard. Contohnya interaksi Magnesium dan alkil
atau aril Halida dalam eter:
Mg + CH3I
→ CH3MgI
Interaksi
langsung alkil atau aril Halida juga terjadi dengan Li, Na, K, Ca, Zn dan Cd.
2. Penggunaan zat
pengalkilasi. Senyawa ini dimanfaatkan untuk membuat senyawa organologam
lainnya. Kebanyakan Halida nonlogam dan logam atau turunan Halida dapat
dialkilasi dalam eter atau pelarut hidrokarbon, misalnya :
PCl3 +
3C6H5MgCl → P(C6H5)3 +
3MgCl2
VOCl3 +
3(CH3)3SiCH2MgCl → VO(CH2SiMe3)3 +
3MgCl2
3. Interaksi
Hidrida Logam atau nonlogam dengan alkena atau alkuna.
4. Reaksi Oksidatif
adisi. Reaksi yang dikenal sebagai reaksi Oksa dimana Alkil atau Aril Halida
ditambahkan pada senyawa logam transisi Koordinasi tidak jenuh menghasilkan
ikatan logam Karbon. Contohnya:
RhCl(PPh3)3 +
CH3I → RhClI(CH3)(PPh3)2 + PPh3
5. Reaksi Insersi
yaitu reaksi yang menghasilkan ikatan-ikatan dengan Karbon, sebagai contoh:
SbCl5 +
2HC CH→Cl3Sb(CH=CHCl)2
CH→Cl3Sb(CH=CHCl)2
Reaksi Grignard ditemukan oleh kimiawan Perancis
Auguste Victor Grignard (1871-1935) di tahun 1901. Tahap awal reaksi adalah
reaksi pembentukan metil magnesium iodida, reagen Grignard, dari reaksi antara
alkil halida (metil iodida dalam contoh di bawah ini) dan magnesium dalam
dietil eter kering.
CH3I
+ Mg –> CH3MgI
Anda pasti melihat bahwa magnisium terikat langsung
dengan karbon. Senyawa semacam ini yang sering disebut sebagai reagen Grignard
dengan ikatan C-logam dimasukkan dalam golongan senyawa organologam. Ikatan
C-logam sangat labil dan mudah menghasilkan karbanion seperti CH3-
setelah putusnya ikatan logam-karbon. Ion karbanion cenderung menyerang atom
karbon bermuatan positif. Telah dikenal luas bahwa atom karbon gugus aldehida
atau gugus keton bermuatan positif karena berikatan dengan atom oksigen yang
elektronegatif. Atom karbon ini akan diserang oleh karbanion menghasilkan
adduct yang akan menghasilkan alkohol sekunder dari aldehida atau alkohol
tersier dari keton setelah hidrolisis.
C6H5CHO
+ CH3MgI –> C6H5CH(CH3)OMgI
Reaksi Grignard adalah contoh reaksi
senyawa organologam. Karena berbagai jenis aldehida dan keton mudah didapat,
berbagai senyawa organik dapat disintesis dengan bantuan reaksi Grignard.
 = Bromo Siklobutana
= Bromo Siklobutana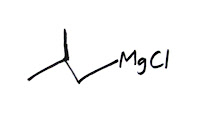

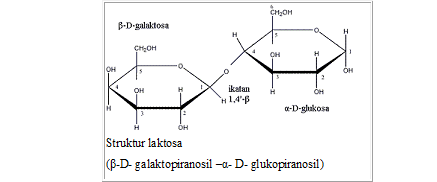 Laktosa
Laktosa













